
Google DeepMind发布了AlphaGenome,一个旨在系统性解析人类基因组中98%非编码区域(即“基因组暗物质”)的AI模型。该模型的核心突破在于,它在单一架构中统一了百万级碱基的长程上下文分析与单碱基的高分辨率预测。通过API,AlphaGenome为科研人员提供了一个强大的工具,能全面评估基因变异对多种生物过程的潜在影响,标志着AI在基础生命科学领域应用的又一重要进展。
自人类基因组草图公布二十余年来,我们对生命蓝图的理解仍存在巨大的空白。我们知道,负责编码蛋白质的基因仅占整个基因组的2%,而剩下高达98%的区域,被称为“非编码区”,其功能在很大程度上仍是未解之谜,常被称为“基因组的暗物质”。
这片“暗物质”并非无用的遗传背景,而是包含了控制基因表达的复杂调控网络。其中一个微小的变异,就可能扰乱细胞的正常功能,与癌症、自身免疫病等多种复杂疾病的发生密切相关。然而,准确预测这些变异的功能性后果,一直是基因组学研究的核心挑战。
Google DeepMind的最新成果——AlphaGenome,正是一项旨在系统性应对这一挑战的重要尝试。它并非简单地发布一个新模型,而是提供了一套方法论,试图统一并深化我们对基因组调控逻辑的理解。

[图1:AlphaGenome模型架构、训练机制及综合评估表现]
图1a展示了AlphaGenome的模型概览,它能处理1Mb的DNA序列,预测横跨11种模态的数千个基因组轨道。图1b和1c描述了其预训练和蒸馏的两个训练阶段。图1d和1e的条形图则展示了其在基因组轨道预测和变异效应预测任务上,相对于当前最佳模型的性能提升。
技术解析:整合长程关联与单碱基精度
以往的基因组模型常常面临一个两难选择:为了分析长距离的基因调控作用(长程),不得不牺牲预测的精细度;反之,要实现单碱基级别的精准预测(高精),又难以捕捉长程依赖。
AlphaGenome的核心技术贡献,在于有效缓解了这一矛盾。
核心架构:卷积与Transformer的协同
AlphaGenome采用了一种混合架构,可以形象地理解为:
-
• 卷积层 (CNNs) 如同微距镜头,负责识别DNA序列中的局部、短小的功能基元(motif),例如转录因子结合位点。 -
• Transformer层则像广角镜头,它整合这些局部信息,在长达100万个碱基对的范围内建立长程依赖关系,理解全局的调控逻辑。
这一设计使其能够在处理大尺度DNA序列的同时,输出精确到单个碱基的预测结果。并且,模型的训练效率也得到了优化,据DeepMind称,其计算成本仅为前代模型Enformer的一半。
性能表现:通用性与准确性的平衡
作为一个通用预测模型,AlphaGenome在多项基准测试中表现出色。在26项关于变异效应预测的评估中,有24项达到或超过了现有的顶尖专用模型(如[图1e]所示)。这表明,该模型可能学习到了基因调控中更为通用和底层的生物学规律。
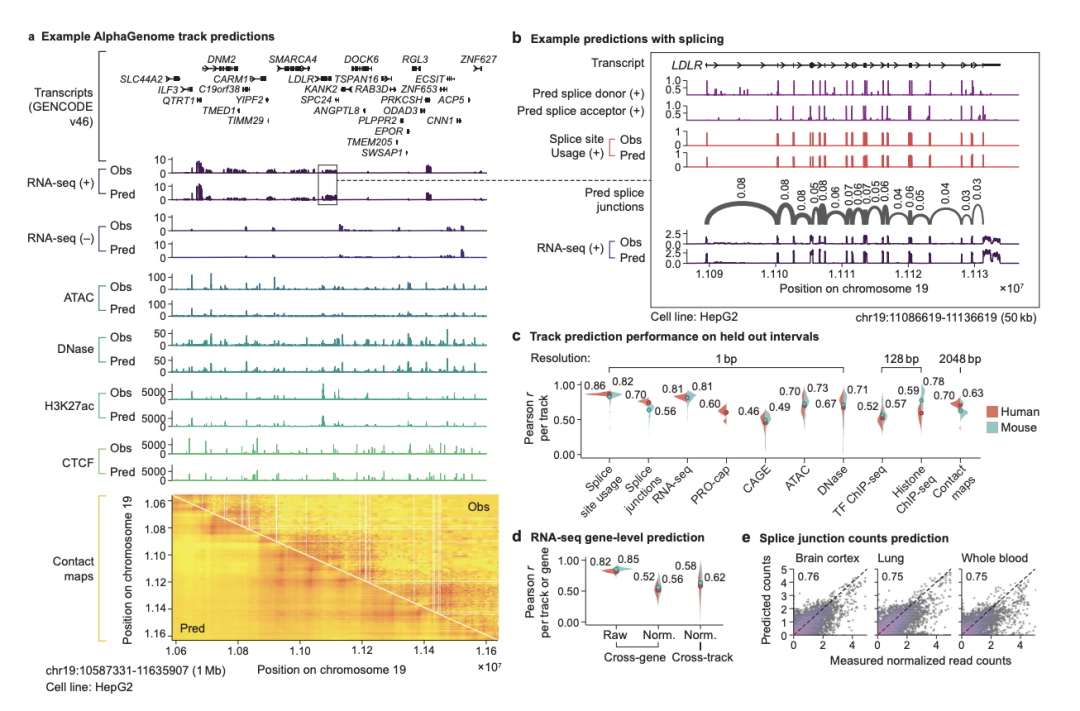
[图2:AlphaGenome基因组轨道预测示例与性能评估]
图2a和2b展示了模型在1Mb区域内对LDLR基因的详细轨道预测,包括RNA-seq、剪接位点等。图2c、2d、2e通过小提琴图和散点图定量评估了模型在不同模态和基因水平上的预测准确性。
模型特性:迈向一体化的基因功能研究平台
AlphaGenome不仅在技术上有所突破,其设计理念也体现了向一体化研究平台的演进。
特性一:集成的多模态预测
传统研究中,评估一个基因突变的完整影响,往往需要借助多个独立的计算工具。AlphaGenome则将多种预测任务整合在一起。用户输入一段DNA序列,即可通过API获得其对基因表达水平、RNA剪接模式、染色质可及性等多个维度的综合性预测。这种集成化设计,显著提升了研究效率。
特性二:对RNA剪接的精细建模
RNA剪接是决定最终蛋白质功能的关键环节,其异常是多种遗传病的直接原因。AlphaGenome是首批能直接从DNA序列,对RNA剪接点的具体位置和表达水平进行建模的AI模型之一。 这为研究相关疾病提供了有力的计算工具。例如,DeepMind在论文中展示,该模型能准确复现T细胞急性淋巴细胞白血病(T-ALL)中一个已知的非编码区突变,如何通过影响蛋白结合来异常激活TAL1致癌基因的机制([图6])。
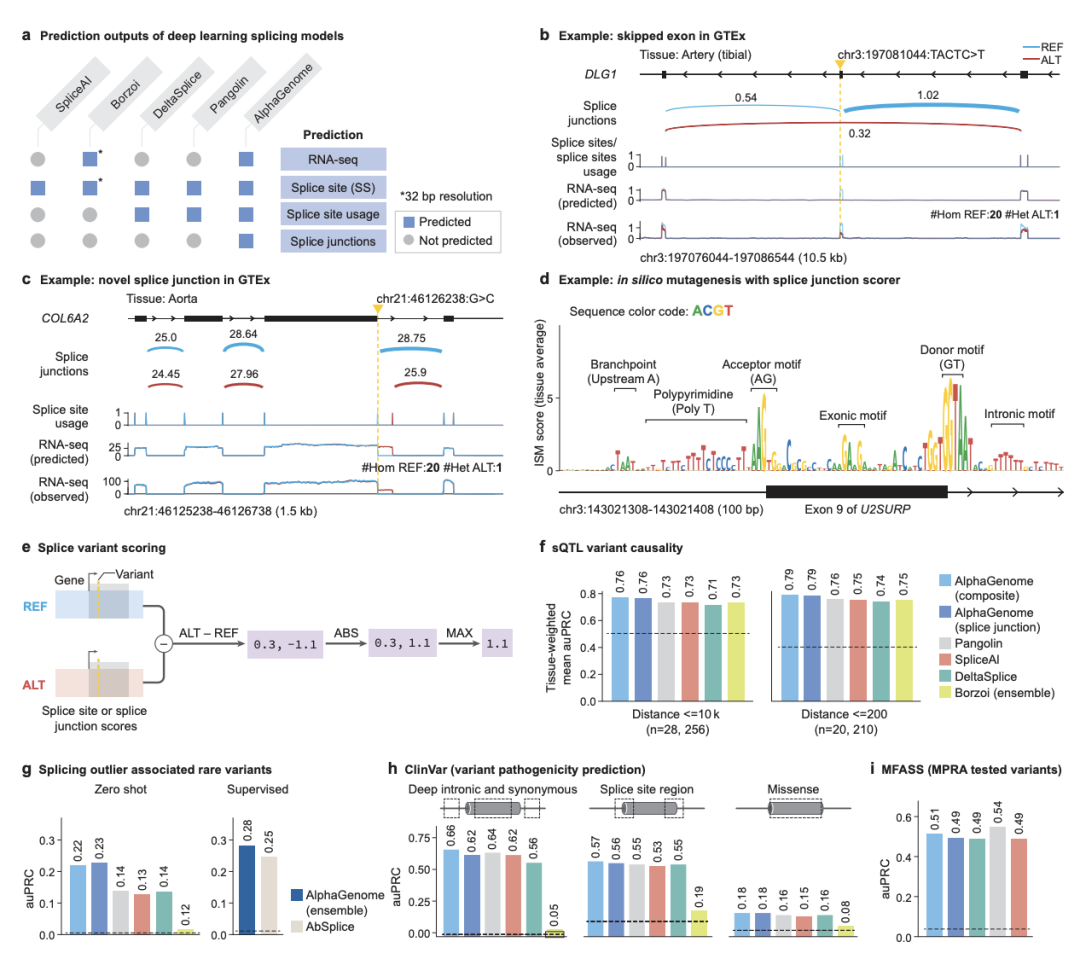
[图3:AlphaGenome作为最先进的剪接变异效应预测模型]
图3a对比了不同深度学习模型在剪接预测方面的能力。图3b至3i通过具体案例(如DLG1基因的外显子跳跃)和基准测试(如sQTL、ClinVar、MFASS)的性能数据,系统地证明了AlphaGenome在剪接事件预测方面的全面性和高精度。
行业视角:演进式创新与范式转变
AlphaGenome的发布,应被置于更广阔的行业背景下审视。
演进式创新
从业界专家的讨论中可以看出,利用深度学习(特别是Transformer)解析基因组并非全新概念,领域内已有诸多优秀的先行工作。从这个角度看,AlphaGenome是站在巨人肩膀上的演进式创新,它整合并优化了现有技术路径。
统一性驱动的范式转变
然而,其真正的价值在于“统一性”。AlphaGenome将长程上下文、单碱基精度、多模态预测和高水平性能这四个关键特性,首次高效地集成在同一个模型框架下。这种“大一统”模型改变了过去研究工具碎片化的局面,有望推动基因组功能研究从“单点分析”走向“系统模拟”,这本身就可能带来研究范式的转变。
资源与开放科学
同时,AlphaGenome的成功也凸显了大规模计算资源(如Google的TPU集群)和高质量公共数据集(如ENCODE、GTEx)在现代生命科学研究中的核心地位,再次印证了开放科学数据对于驱动领域进步的巨大价值。
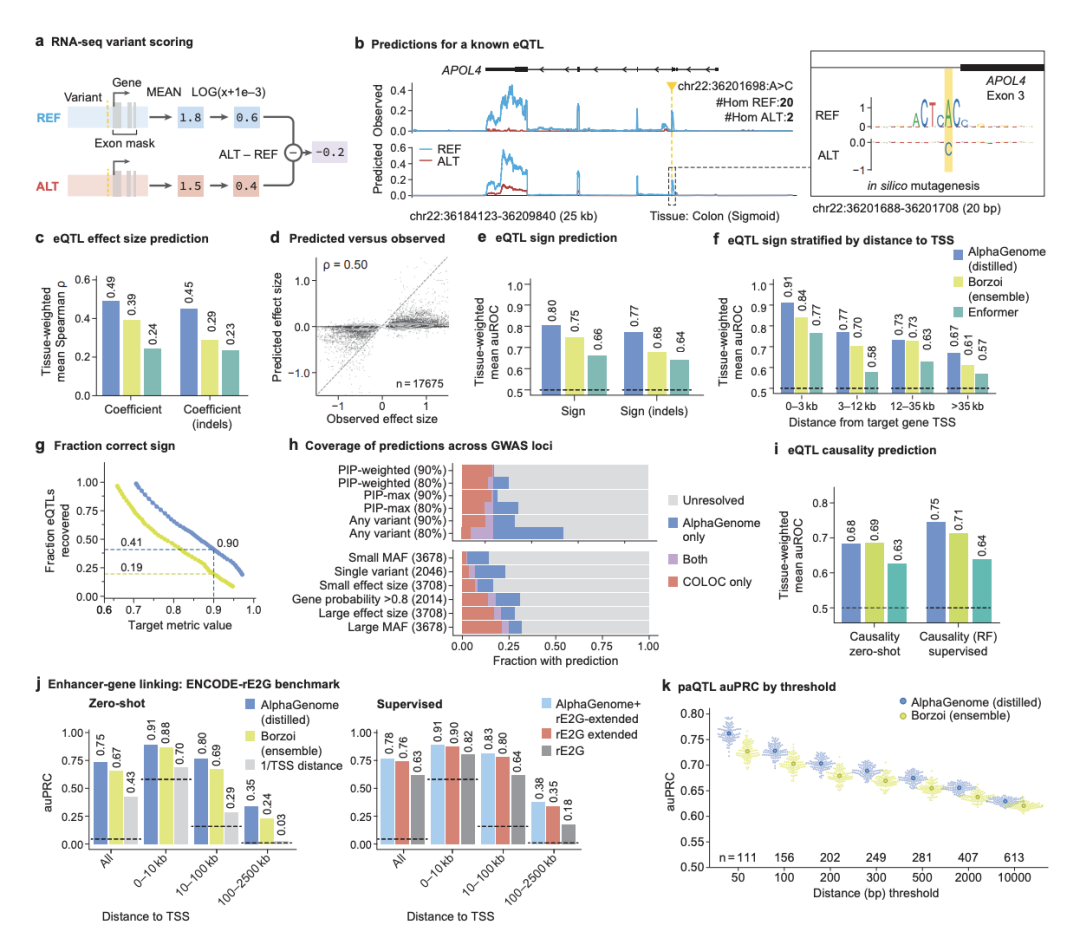
[图4:AlphaGenome预测变异对基因表达的影响]
该图详细展示了模型在表达数量性状位点(eQTL)预测方面的能力。包括一个已知eQTL的预测示例(图4b),与基准模型的性能对比(图4c,e),以及在GWAS信号解读中的应用(图4h),展示了其在基因变异与基因表达变化方面的强大功能。
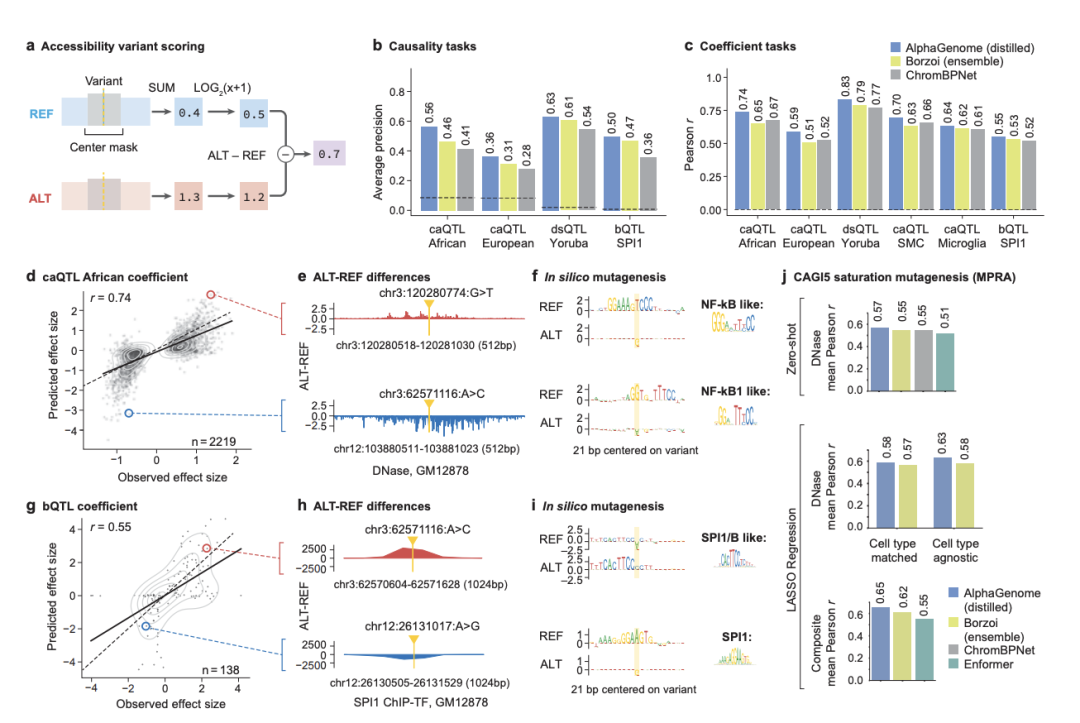
[图5:AlphaGenome准确预测变异对染色质可及性和转录因子结合的影响]
此图聚焦于染色质状态的预测,通过caQTL、dsQTL和bQTL等任务,展示了模型在预测变异如何影响DNA开放性及特定蛋白(如SPI1)结合方面的性能,并通过计算机模拟突变(ISM)揭示了其背后的基序(motif)变化机制。
应用指南:一个强大的研究工具及其边界
DeepMind已通过API向非商业研究者开放了AlphaGenome。了解其适用场景和局限性至关重要。
潜在应用场景:
-
1. 疾病机制探索:帮助研究者在全基因组关联分析(GWAS)发现的候选区域中,筛选出最有可能具有功能的致病变异,为药物靶点发现提供线索。如[图6]所示,模型成功地解释了T-ALL癌症中TAL1基因的激活机制。 -
2. 合成生物学:辅助设计具有特定调控功能的DNA序列,如构建仅在特定条件下激活的基因回路。 -
3. 基础生物学研究:系统性地绘制基因组的功能元件图谱,加深对细胞身份和功能的理解。
需要明确的局限性:
-
• 非临床诊断工具:模型的预测结果仅供科研探索,未经临床验证,不能用于个人健康决策。 -
• 预测不等于因果:这是科学应用中的核心原则。AlphaGenome能预测一个变异的潜在功能,但无法直接断定其与疾病的因果关系。确定因果性仍需依赖严谨的实验设计和群体遗传学统计。它是一个强大的假设生成器,而非最终的答案。 -
• 技术边界:对于超过百万碱基对的超远距离调控和更精细的细胞状态特异性,模型的能力仍有提升空间。 -
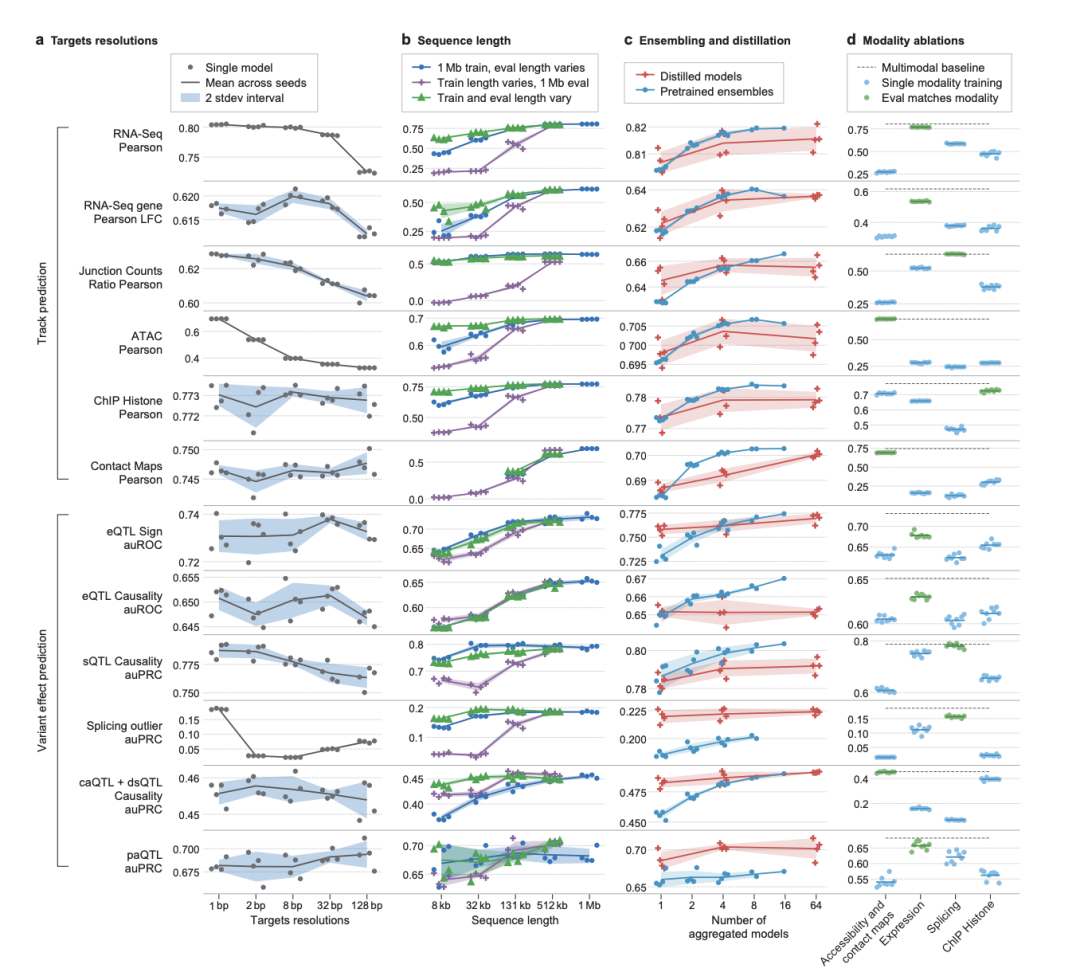
[图7:模型设计选择对性能的影响]
该图通过一系列消融实验,系统地分析了不同设计决策(如目标分辨率、序列长度、集成/蒸馏策略、多模态学习)对模型性能的影响,为未来模型的优化提供了宝贵的经验数据。
未来展望:通往“基因组操作系统”的构想
AlphaGenome的深远意义,或许在于它所代表的一种发展方向。
如果说AlphaFold让我们能“看清”生命的基本硬件——蛋白质的三维结构,那么AlphaGenome则是在尝试“理解”控制这些硬件运行的“底层软件”——基因调控程序。
随着AlphaGenome(调控预测)、AlphaFold(结构预测)和AlphaMissense(编码区变异影响预测)等工具的成熟与整合,科学界正逐步构建起一个前所未有的“基因组集成开发环境(IDE)”。在这个概念框架下,科学家不仅能更高效地“调试”与疾病相关的遗传密码,也为未来通过合成生物学“编写”新的生命功能提供了更坚实的理论和计算基础。
AlphaGenome所照亮的,不仅仅是98%的基因组未知区域,更是AI与生命科学深度融合,共同探索生命本质的未来之路。
推荐阅读
-
• AlphaGenome 官方博客:https://deepmind.google/discover/blog/alphagenome-ai-for-better-understanding-the-genome/ -
• AlphaGenome 预印本论文:https://storage.googleapis.com/deepmind-media/papers/alphagenome.pdf
关键词标签AlphaGenome, Google DeepMind, 基因组学, 非编码DNA, 人工智能
(文:子非AI)

