西风 发自 凹非寺
量子位 | 公众号 QbitAI
无特效疗法、无法根治的疾病,现在被「AI科学家」发现了潜在新疗法。
核心流程完全由AI驱动,人类研究员仅执行了实验室实验和最终论文撰写的那种。

最近非营利性组织Future House宣布了一个最新成果:
可以致盲的眼部疾病——干性年龄相关性黄斑变性(dAMD),或许有救了。
他们用一个多智能体系统,成功锁定Ripasudil这种已在日本获批用于临床治疗青光眼的ROCK抑制剂,对这种病具有潜在治疗效果。
团队咨询了多位有关此疾病领域的专家,均对这一发现的创新性和价值持认可态度。
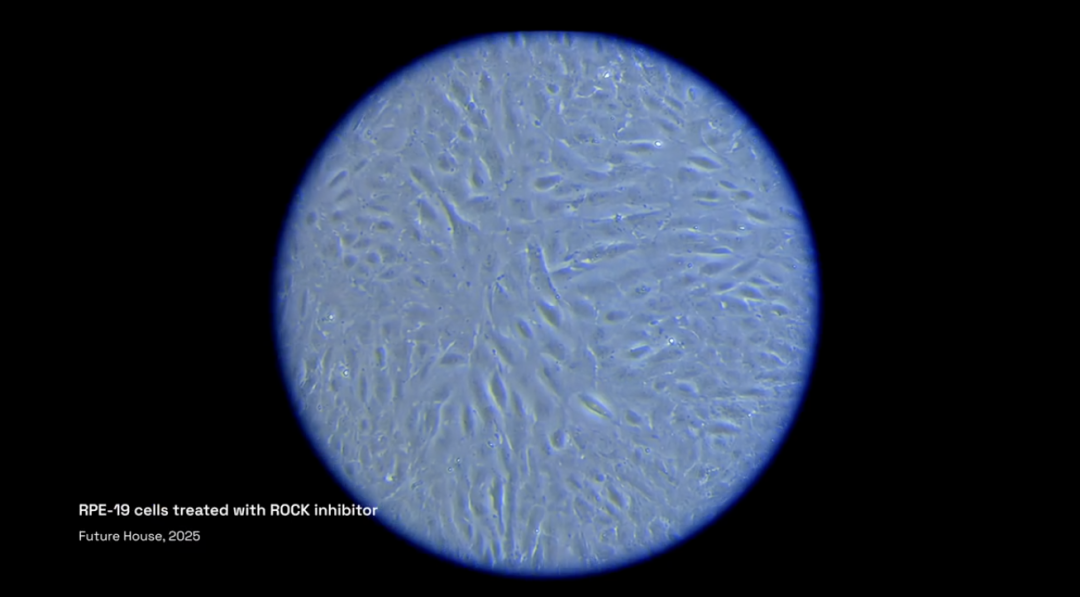
重要的是,除实验室实际物理实验操作和最终手稿撰写外,论文形成所需的核心环节均由智能体完成,包括提出假设、实验设计、数据分析到迭代优化的全流程。
甚至Agent还协助完成了论文图表的绘制。
整个研究仅耗时约10周,远短于研究团队手动完成所有计算机模拟环节的时间。
团队还特别说明,他们此前从未在其他文献中发现有人提出使用ROCK抑制剂治疗dAMD:
如果没有这些Agent,我们很难提出这一假设。

另外研究团队还表示,将在下周开源代码和数据。
这一成果公布后引来大量网友关注和转发。
有网友表示这有点太疯狂:
很难想象当我们有了能够甚至取代一切的机器人时会发生什么。
接下来一起来看看这个“AI科学家”到底长啥样。
完全自动化科学发现关键知识步骤
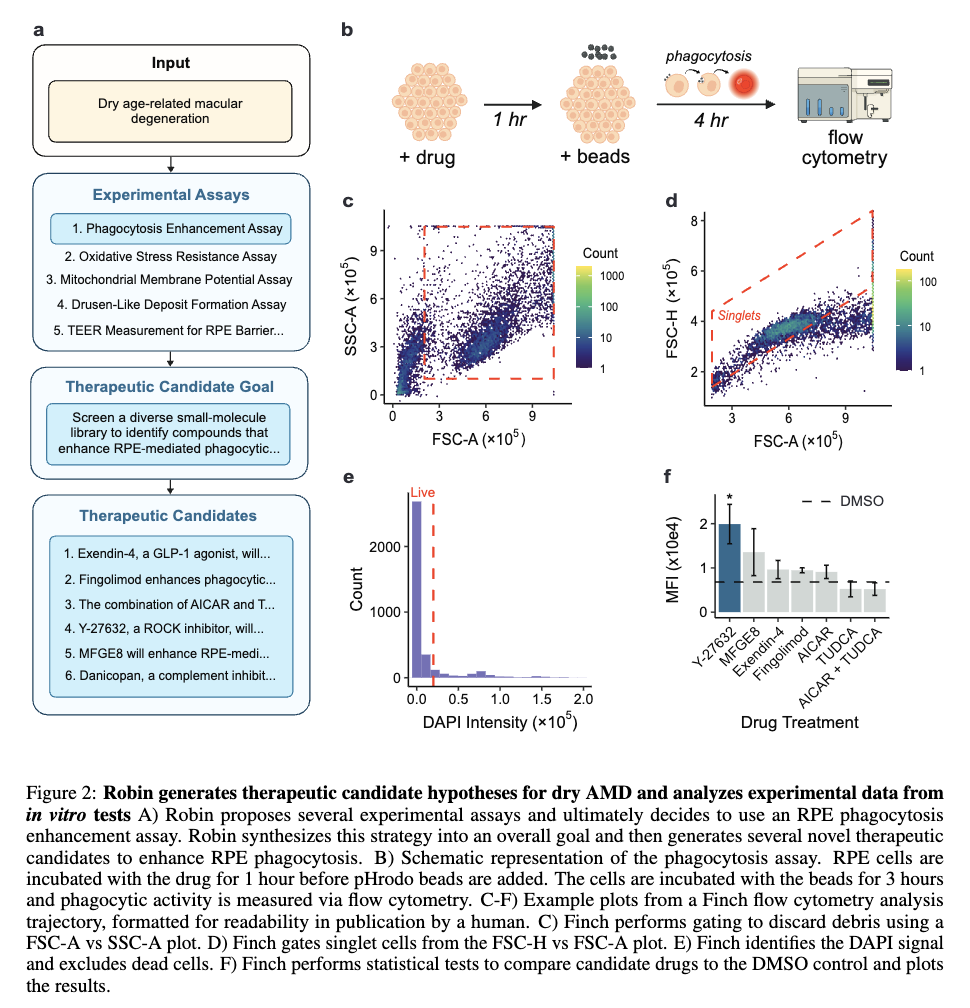
完成这一发现的,是一个名为“Robin”的多智能体系统,集成了Crow、Falcon、Finch三个智能体。
据介绍,它主要通过假设生成、实验设计和数据分析的迭代循环完成了这一发现,发现过程具体来说是酱婶儿的……
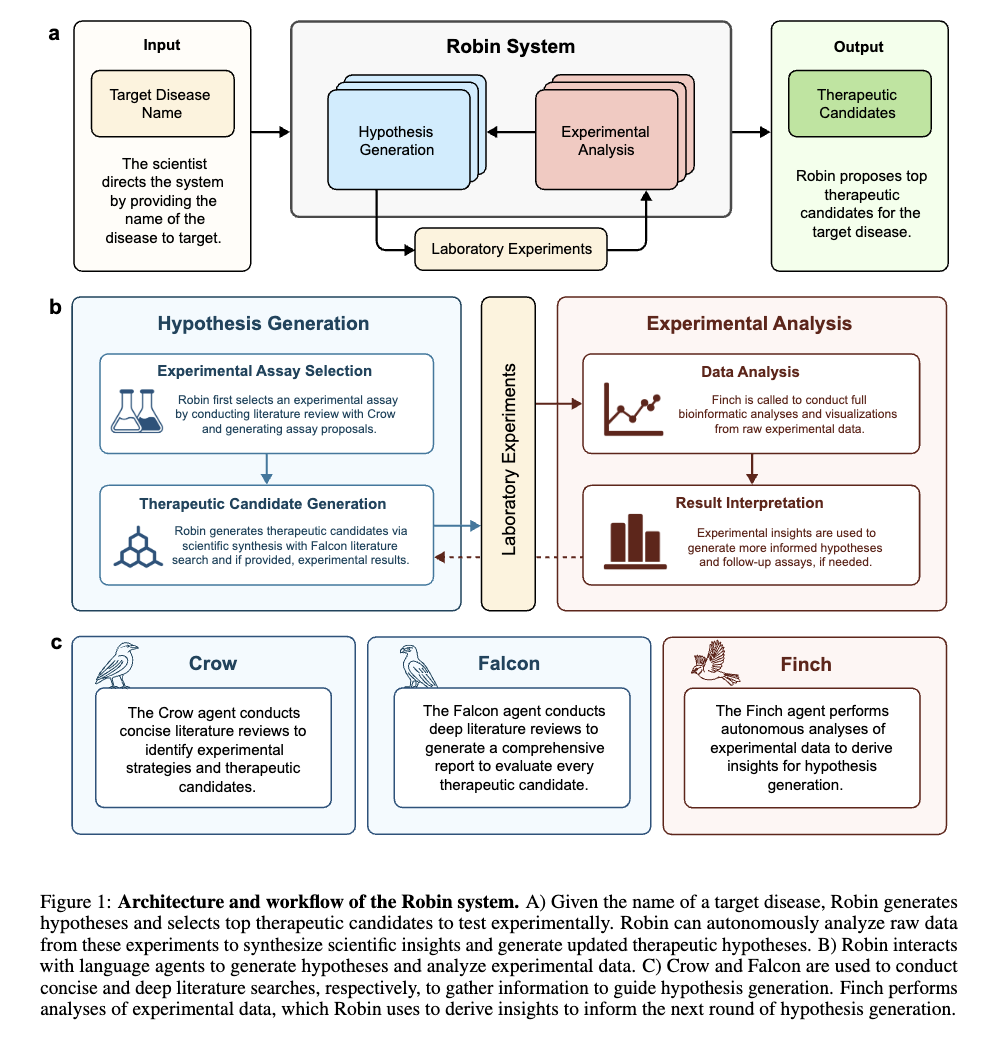
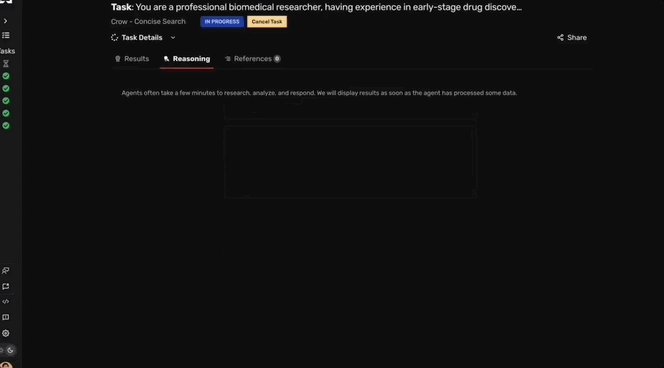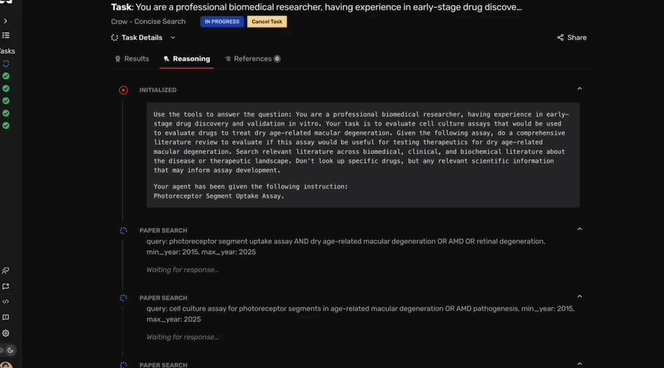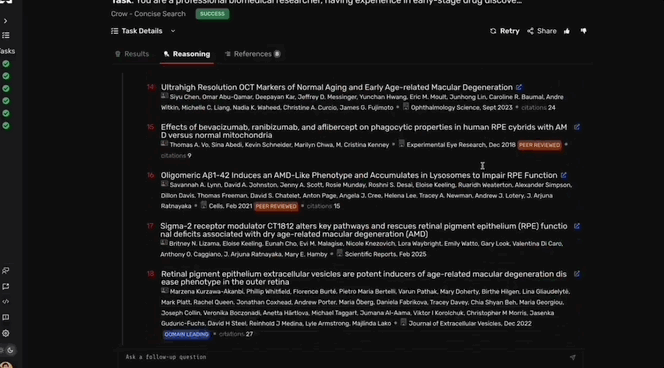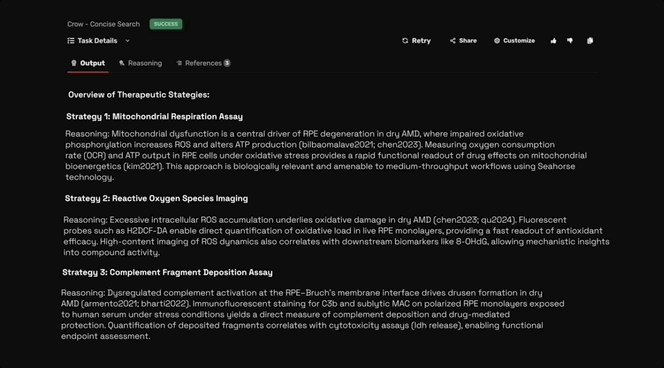
在初始假设阶段,Robin调用Crow进行广泛的文献回顾,首先识别并回顾151篇文献,提出了10种与干性AMD相关的生物学机制用于分析。
在对疾病机制和相应实验策略进行排序后,Robin提出假设:通过增强视网膜色素上皮(RPE)细胞吞噬作用对治疗干性AMD(dAMD)有帮助。
并建议通过流式细胞术检测药物对来自于患者的RPE细胞或ARPE-19细胞吞噬能力的提升效果。
随后,Robin调用Crow对约400篇关于RPE吞噬作用和干性AMD治疗现状的文献进行分析,综合分析出30种现有候选药物用于吞噬作用实验测试。
Robin进一步调用Falcon为每种分子生成全面评估报告,并通过LLM判断的“竞争排序”对候选药物进行优先级排列。

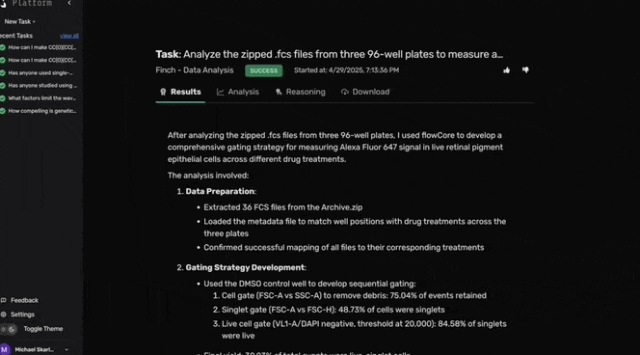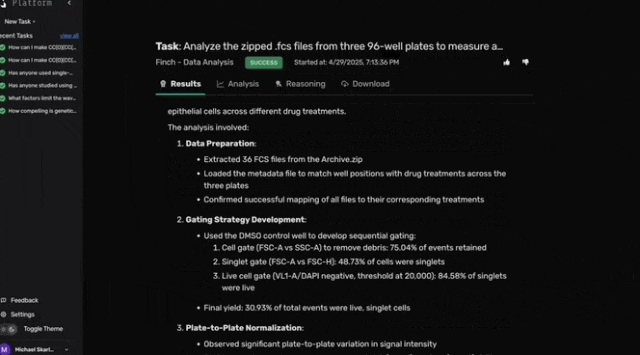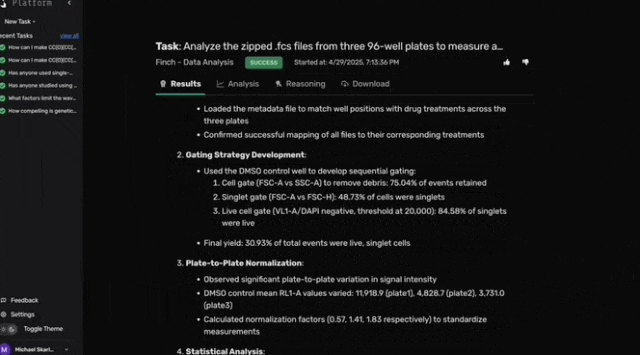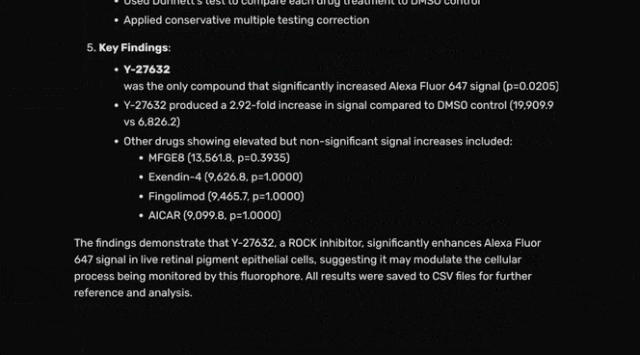
团队从上述排序中选出前五种候选药物进行实验测试,包括Exendin-4、Fingolimod、MFGE8、Y-27632以及AICAR与TUDCA的组合。
尽管Robin建议使用荧光标记的光感受器外段作为RPE吞噬作用的底物,但由于材料限制,团队改用pHrodo荧光微球。pHrodo微球在溶酶体的酸性环境中激活荧光,可通过流式细胞术检测单细胞的吞噬活性。
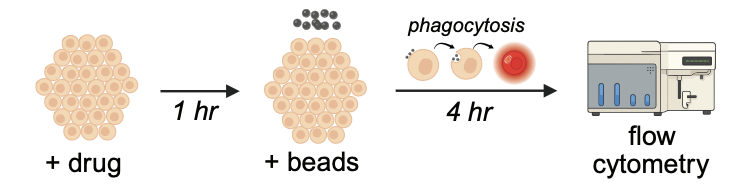
在RPE吞噬实验中测试这些候选药物后,原始流式数据、相关元数据及分析指令被上传至Robin。
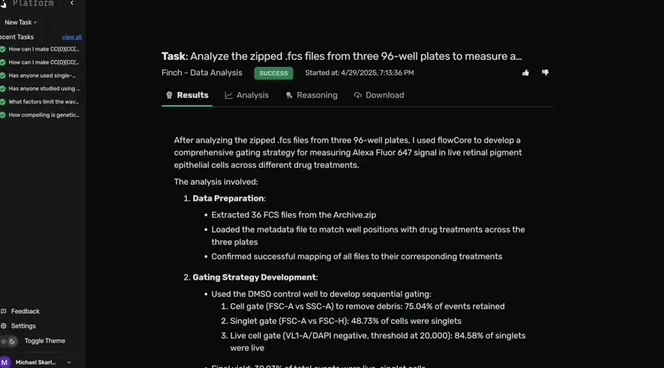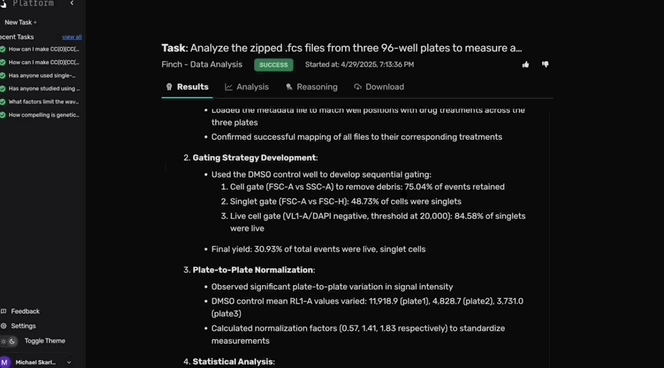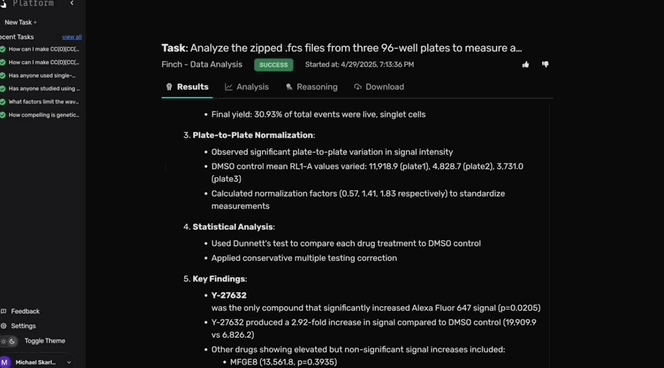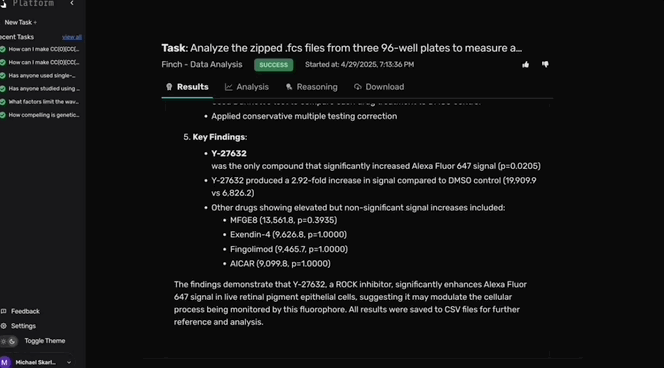
Robin调用Finch分析数据,Finch开发了Jupyter Notebook,通过门控分析流式数据并进行统计检验,量化各化合物对RPE吞噬作用的影响。
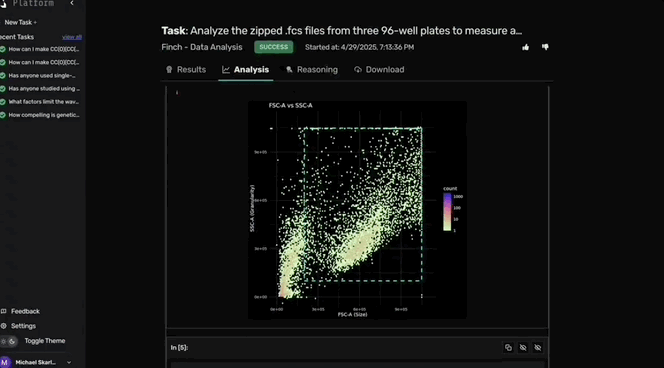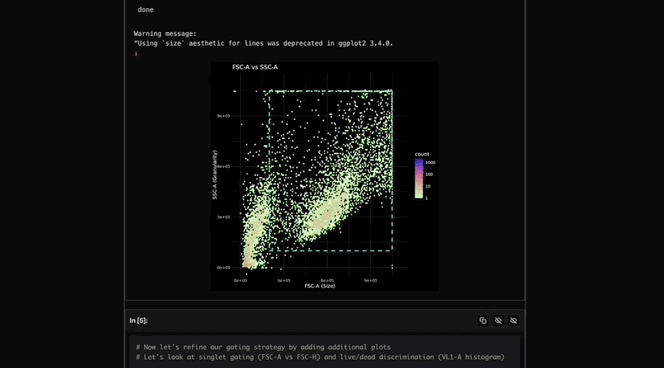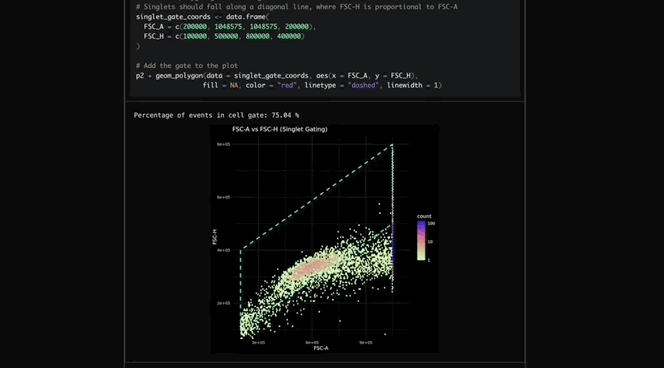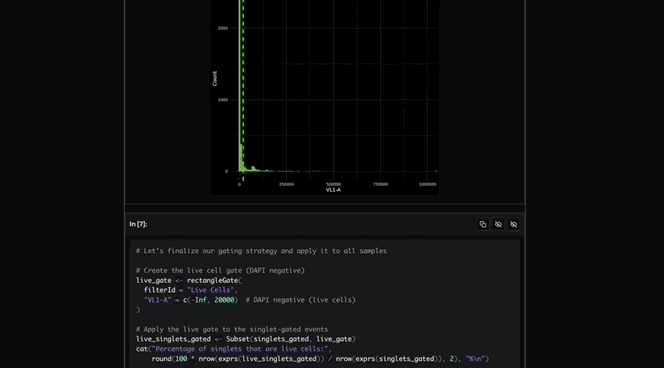
图c-f展示了代表性的Finch分析轨迹结果,这些结果通过人工分析相同数据得到了验证。
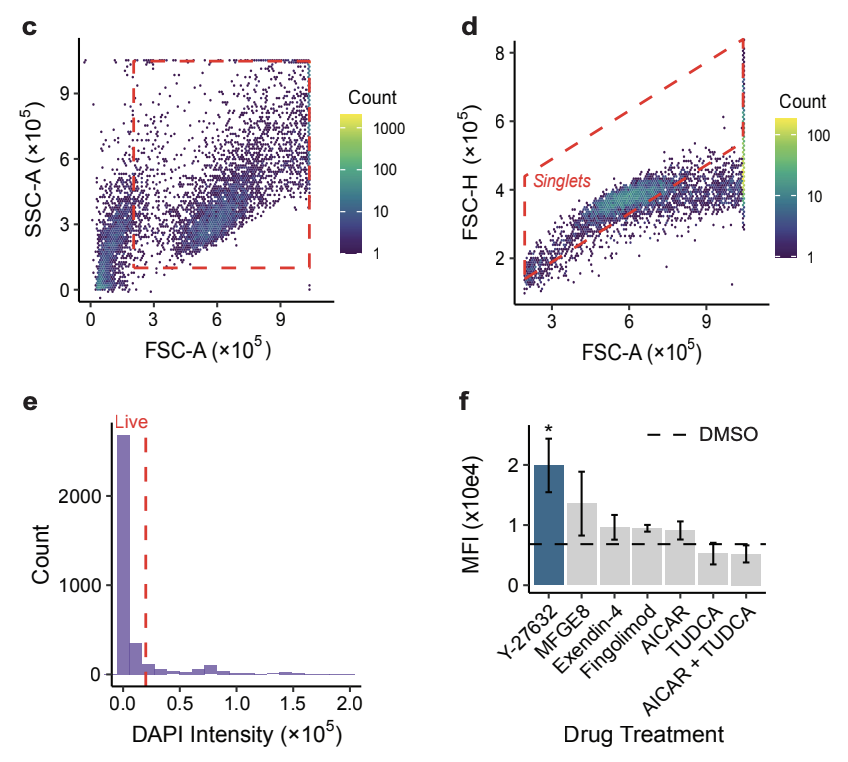
临床前模型已证实Rho激酶抑制剂Y-27632可恢复RPE细胞的吞噬效率,印证了Robin基于文献提出该候选药物的合理性。
分析初始流式结果后,Robin建议对Y-27632处理的RPE细胞进行RNA测序,以探究ROCK抑制的转录效应。
团队展开了第二轮Y-27632处理的RPE吞噬实验,并通过批量RNA测序分析样本。
Finch进行差异基因表达(DGE)分析并以火山图形式总结结果。
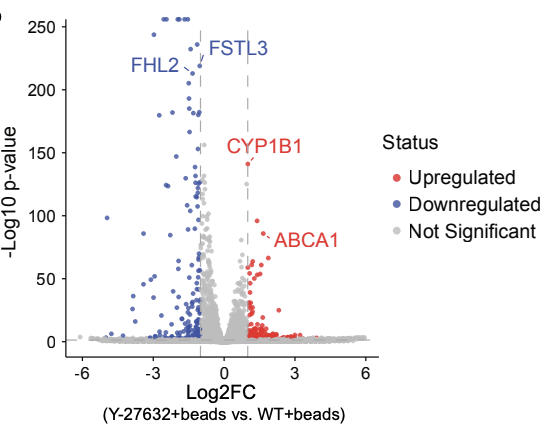
既往研究表明Y-27632通过翻译后调控F-肌动蛋白动力学促进吞噬杯形成,而Finch的DGE分析发现,Y-27632处理还在吞噬过程中诱导RPE细胞发生快速转录变化。
Finch的共识分析显示,在超过50%的分析轨迹中均识别出相同的显著差异表达基因。
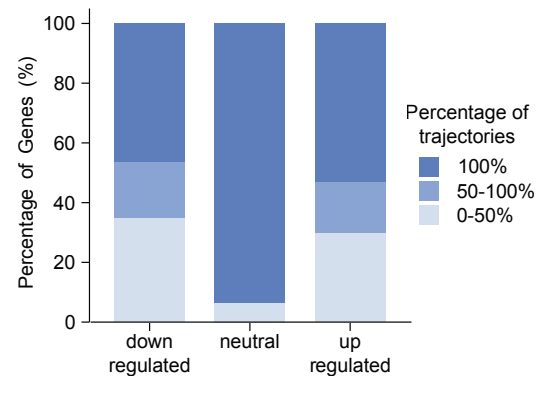
随后,Finch进一步分析,发现Y-27632显著改变了肌动蛋白丝组织、小GTP酶介导的信号转导及自噬通路相关基因的表达。
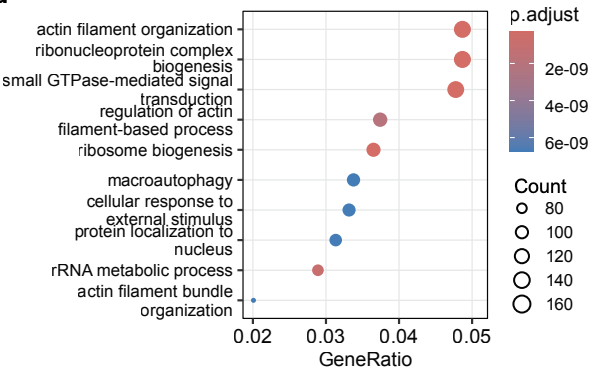
这些结果提示,Y-27632通过细胞骨架重排增强吞噬作用的初始摄取阶段,并通过自噬转录调控促进内化物质的清除。
目前尚需进一步研究确认这些变化是Y-27632特异性的,还是可推广至其它显著增强吞噬能力的干预措施(人工分析结果与Finch相似)。
接着,Robin利用Finch分析了这些实验数据,发现Y-27632在细胞培养中增强了RPE的吞噬作用。
DGE分析发现,关键脂质外排泵(lipid efflux pump)ABCA1在Y-27632处理的细胞中上调3倍(校正p值= 2.13×10⁻⁸³)。
ROCK抑制剂诱导的吞噬作用中ABCA1的差异表达对干性AMD具有重要意义,ABCA1对维持RPE细胞健康功能至关重要,ABCA1促进胆固醇和磷脂从细胞膜向受体蛋白的主动转运,随后排出细胞。
值得注意的是,ABCA1与ABCA4同属转运蛋白家族,而ABCA4已被确认为黄斑变性发病机制中的治疗靶点。与干性AMD病理更直接相关的是,ABCA1的脂质受体载脂蛋白E(Apo-E)也被认为是干性AMD的潜在治疗靶点。
团队表示,这些由Robin提出实验方案并经Finch分析得出的机制性见解,证明了AI驱动的科学发现不仅能识别有效治疗化合物,还能揭示疾病通路中可能被忽视的新型分子靶点。
除了建议对Y-27632进行RNA测序分析外,Robin还对候选药物假设进行了后续迭代。团队通过实验测试了其中10种药物,并将数据提供给Finch进行分析。
Finch的分析显示,已在日本获批用于治疗青光眼Rho激酶(ROCK)抑制剂ripasudil,其表现优于Y-27632,与DMSO对照组相比可使RPE细胞吞噬作用提升7.5倍(人工分析显示提升1.75 倍)。
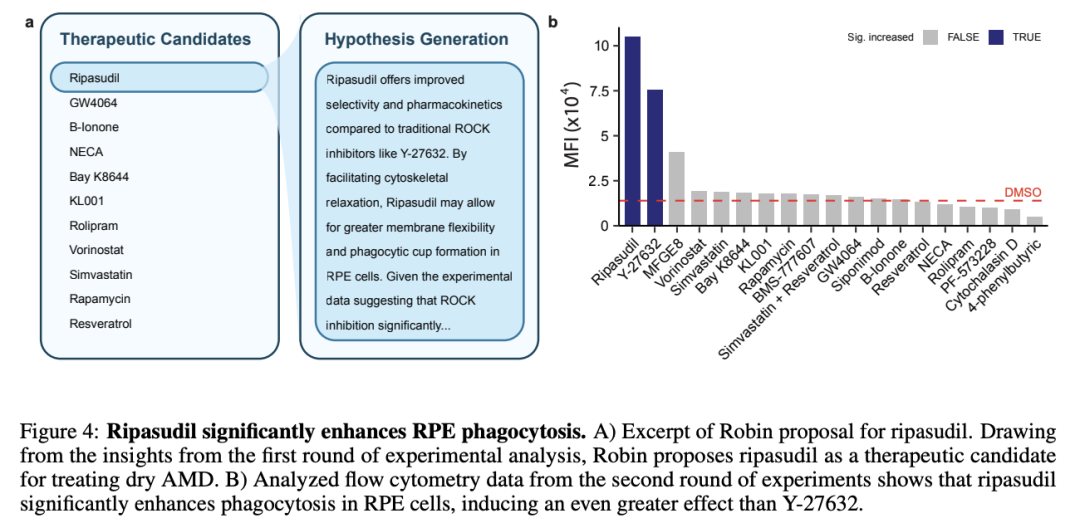
团队认为尽管需要通过不同剂量和更长孵育时间的进一步测试才能做出明确比较,但ripasudil相对于Y-27632的初步优势表明,Robin能够通过迭代实验和反馈逐步优化治疗假设。
最后FutureHouse生物科研团队还特别说明,此次发现尚未完成人体试验验证,距离临床应用仍需经历规范的医学研究流程。
FutureHouse团队简介
简单介绍一下FutureHouse团队。
官网显示,FutureHouse是一个非营利性组织,由Sam Rodriques和Andrew White联合创立,致力于开发AI Agent以实现生物学及其它复杂科学领域的研究自动化。
Sam Rodriques是FutureHouse CEO,也是一名物理学家和生物工程师,曾发明了用于空间和时间转录组学、脑图谱绘制、基因治疗和纳米制造的技术。
在创立FutureHous之前,他曾在弗朗西斯·克里克研究所短暂运营过一个学术实验室。
Andrew White是科学负责人,是一位在LLMs、化学、可解释AI、统计力学和化学工程领域拥有超50篇同行评审出版物、书籍的研究员,并曾获得包括美国国家科学基金会(NSF)和美国国立卫生研究院(NIH)颁发的青年研究员奖在内的多项奖项。
Andrew White还担任超过30份期刊的同行评审以及多个国家级和私人资助机构的评审,并担任美国国家科学院化学科学圆桌会议成员。
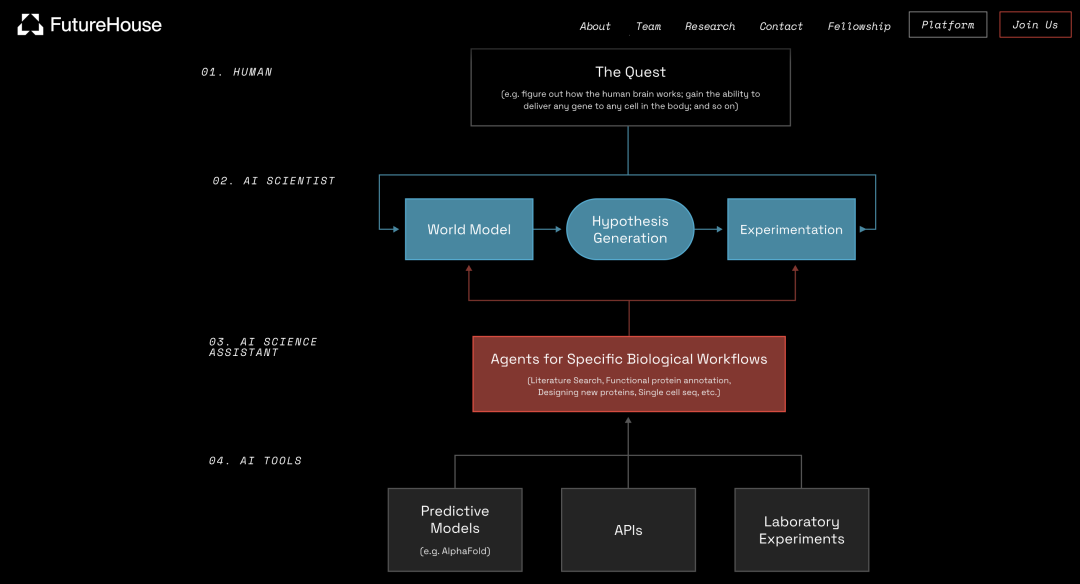
团队列出了科学自动化的四个层面,并表示将逐一探究每个层面。
网友提出质疑,早有文献记载?
Robin的发现被公开后引来不少生物科技从业者的关注和点赞。
还有一些患者或者家里有患此疾病的网友纷纷表示看到了希望。

不过,也有网友持科学严谨的态度对这项成果提出了质疑。
有网友指出,针对AMD,人们已经对ROCK抑制剂进行过研究,利用ROCK抑制剂增强干性AMD患者的细胞吞噬作用,这一研究内容也早有相关文献记载。

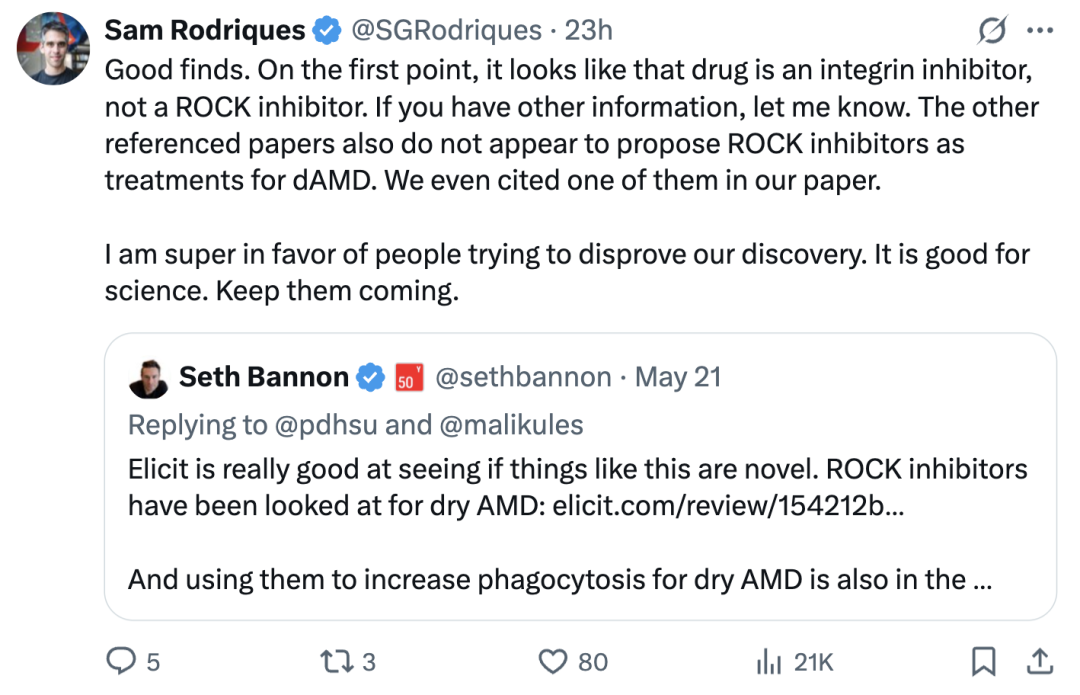
FutureHouse团队成员对此做出回应:
关于第一点,看起来那药物是整合素抑制剂,而非ROCK抑制剂。其它参考文献似乎也没有提出将ROCK抑制剂作为干性AMD的治疗手段,我们甚至在自己的论文中引用了其中一篇(网友给出的两个链接中的一篇)。
非常支持大家尝试反驳我们的发现,这对科学有益。请继续提出。
请继续提出那就继续,网友再次开麦:
关于第一篇论文,你说得对,Risuteganib是整合素抑制剂,而非ROCK抑制剂。
至于其它论文,例如Croze的研究确实明确提出将ROCK抑制剂作为干性AMD的治疗手段,不过我认为Croze并未将“增强吞噬作用”作为治疗策略。
以下是对这一问题的思考你看正确不?
使用ROCK抑制剂治疗干性AMD——并非创新
使用ROCK抑制剂增强吞噬作用——并非创新
通过增强吞噬作用来治疗干性AMD的ROCK抑制剂应用——具有创新性

FutureHouse也再次回应:
我们的内部概念体系如下:
使用ROCK抑制剂增强吞噬作用——非创新性
通过增强吞噬作用治疗干性AMD——非创新性
(通过增强吞噬作用)使用ROCK抑制剂治疗干性AMD——具有创新性我认为这一概念体系仍然成立,但我们明天会进行复核,如有变动将及时更新。
在最新这篇论文中,针对地图样萎缩(GA)的治疗与干性AMD的一般性治疗之间的区别至关重要。因为GA患者的视网膜已经萎缩,必然存在一定视力损失;而若在干性AMD进展为GA之前进行治疗,则有望预防视力丧失。此外,GA患者仅占所有干性AMD患者的一部分。
那么,对于这项成果你怎么看?
论文链接:https://arxiv.org/pdf/2505.13400
官方Blog:https://www.futurehouse.org/research-announcements/demonstrating-end-to-end-scientific-discovery-with-robin-a-multi-agent-system
(文:量子位)

